| シクロデキストリン(環状オリゴ糖)は分子の中心に穴(空洞)があります。そのため、空洞の大きさに合った大きさの化合物を物理的な引力によって取り込む(包接する)ことがあります。空洞の中は疎水性なので空洞の大きさに合った疎水性の有機化合物が包接されることが多いのです。シクロデキストリンのように他の分子を包接する分子を「ホスト」、包接される分子を「ゲスト」ということがあります。そこで、このような現象をホストーゲストの化学とも呼ぶことがあります。 |
ゲスト分子がホスト分子に包接されて生じた複合体を包接錯体といいます。 包接現象では分子が化学結合せずに物理的な引力(分子間力)で包接錯体を作り、包接錯体が1つの分子のような振る舞いをすることになります。したがって、包接錯体を超分子と見なすこともできます。そのため、ホストーゲストの化学を超分子化学ということもあります。
シクロデキストリンは構成しているD-グルコピラノースの数によってα-シクロデキストリン、β-シクロデキストリン、γ-シクロデキストリンなどがあります(「構造-1」の項目参照)。当然、シクロデキストリンの空洞の大きさが違うので、包接されやすい分子も違ってきます。α-シクロデキストリンにはベンゼンが包接されやすく、β-シクロデキストリンにはナフタレンが包接されやすいのです。γ-シクロデキストリンはもっと大きい分子でも包接されます。
包接錯体は結晶として取り出せることもあります。また、上の図に示したように水溶液中で単独のゲスト分子とシクロデキストリンとの包接錯体が平衡状態として存在することもあります。 |
右の図はβ-シクロデキストリンの2級水酸基側(空洞の広い側)からナフタレン分子が包接される様子をアニメーションで表わしてあります。炭素、酸素、水素はそれぞれ灰色、赤色、水色で表わしてあります。また、ピンク色は酸素の非共有電子対を表わしています。
図の上にマウスのカーソルを持っていくとナフタレン分子が包接される様子を見ることができます。
|
|
|
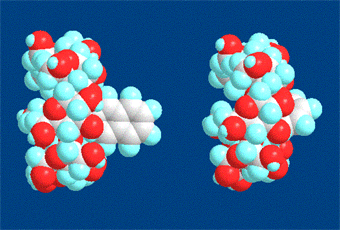
上のアニメーションの最初の図と最後の図を原子の大きさで表わした分子モデルで示した図です。
ナフタレンが包接される前(アニメーションの始まる前)と後(アニメーションが終わったとき)の様子をそれぞれ左側と右側の図で示しています。つまり、左側の図が包接前で右側の図が包接後です。包接後ではナフタレン分子がβ-シクロデキストリンの空洞の中に入っているのがわかります。
|
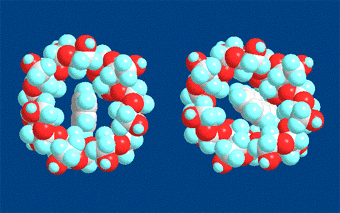
|
包接前と後の状態をそれぞれ90度回転してβ-シクロデキストリンの空洞が見える1級水酸基側(空洞の狭い側)から見た図です。
左側の図が包接前で右側の図が包接後です。ナフタレンが包接されるとβ-シクロデキストリンが少しひずんでいる様子がわかります。β-シクロデキストリンが少しひずむことにより、ナフタレンとより強く接触できるようになり包接錯体がエネルギー的に安定な状態になると考えられます。
|
|
■疎水性
水との相互作用が弱く、水との親和性が弱い性質をいいます。
■分子間力
分子間力は分子と分子の間に働く力のことをいいます。
■超分子
分子が複数集まって1つの分子のように振舞う集合体を超分子といいます。
■ベンゼン
ベンゼンの分子式はC6H6です。
芳香族化合物の基本となる化合物で、常温で液体です。
■ナフタレン
ナフタレンの分子式はC10H8です。常温で結晶ですが、特有の臭いがあります。
■非共有電子対
他の原子との結合に関与せずに2個の対となっている外殻電子のことをいいます。
|
|





