 |
| 「シクロデキストリンと環状オリゴ糖 」 |
| 糖分子が2〜20個程度つながっているものをオリゴ糖といいます。オリゴ糖が環状になっているものを環状オリゴ糖といいます。したがって、シクロデキストリンのことを環状オリゴ糖ということもあります。 |
| 酵素 |
| 酵素は分子量が1万から100万位のタンパク質で、触媒の1種として生体での化学反応を促進する働きをします。 |
| タンパク質 |
| タンパク質は多数のL-アミノ酸がペプチド結合したペプチド鎖からなる。ペプチド鎖はそれぞれのタンパク質に固有のアミノ酸残基の配列を持っている。 |
| L-アミノ酸 |
| アミノ酸は分子内にカルボキシル基(-COOH)とアミノ基(-NH2)をもった化合物をいいます。グルコースと同様にアミノ酸にも光学異性体であるD-体とL-体が存在しますが、天然にあるものはL-体です。 |
| ペプチド結合 |
| アミノ酸は分子内にカルボキシル基(-COOH)とアミノ基(-NH2)をもっています。アミノ酸のカルボキシル基が別のアミノ酸のアミノ基と縮合脱水して-CO-NH-という結合を作って2つのアミノ酸分子がつながることができます。そのときできる-CO-NH-結合をペプチド結合といい、この結合でアミノ酸が鎖のように数多くつながってできたものをペプチド鎖ということがあります。 |
| ペプチド鎖 |
| アミノ酸は分子内にカルボキシル基(-COOH)とアミノ基(-NH2)をもっています。アミノ酸のカルボキシル基が別のアミノ酸のアミノ基と縮合脱水して-CO-NH-という結合を作って2つのアミノ酸分子がつながることができます。そのときできる-CO-NH-結合をペプチド結合といい、この結合でアミノ酸が鎖のように数多くつながってできたものをペプチド鎖ということがあります。 |
| カルボキシル基 |
| カルボキシル基(-COOH)の水素原子(H)はプロトン(H+)として離れやすい性質をもっています。したがって、カルボキシル基をもった化合物は酸の働きをします。酢酸(酢に含まれている酸)はその代表的な物質です。 |
| 光学異性体 |
| 分子の立体構造が重ねあわすことのできない像と鏡像関係にある異性体を光学異性体といいます。この鏡像関係は右手と左手の関係と同じです。偏光に対する振る舞いが光学異性体では異なります。 |
| アミラーゼ |
| デンプンなどのα1―>4結合の加水分解反応に触媒として働く酵素をアミラーゼといいます。 |
| α1―>4結合 |
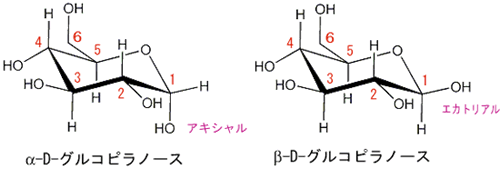 上の図はα-D-グルコピラノースとβ-D-グルコピラノースの構造を表わしています。 D-グルコピラノースの炭素原子を区別するために1から6までの番号をつけます。D-グルコピラノースの1位の炭素原子についているヒドロキシル基がアキシャルのものをα-D-グルコピラノース、エカトリアルのものをβ-D-グルコピラノースといいます。 上の図はα-D-グルコピラノースとβ-D-グルコピラノースの構造を表わしています。 D-グルコピラノースの炭素原子を区別するために1から6までの番号をつけます。D-グルコピラノースの1位の炭素原子についているヒドロキシル基がアキシャルのものをα-D-グルコピラノース、エカトリアルのものをβ-D-グルコピラノースといいます。α1―>4結合はα-D-グルコピラノース分子の1位のヒドロキシル基と他のα-D-グルコピラノース分子の4位のヒドロキシル基が脱水縮合してできる結合をいいます。 |
| D-グルコース/ブドウ糖 |
| D-グルコース(ブドウ糖ともいいます)の分子式はC6H12O6で、炭素(C)原子6個、水素(H)原子12個、酸素(O)原子6個からできています。 |
|
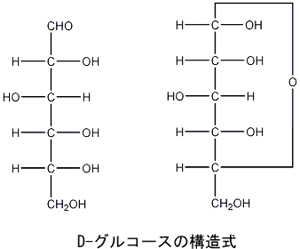
D-グルコース(ブドウ糖ともいいます)の分子式はC6H12O6で、下の図に示したように炭素(C)原子6個、水素(H)原子12個、酸素(O)原子6個からできています。
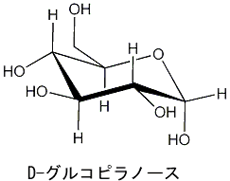
D-グルコースの左の構造式は鎖状のもので、右の構造式は環状のものですが、2つとも炭素、水素、酸素の原子数は 同じです。この環状のD-グルコースをD-グルコピラノースと呼びます。D-グルコースは溶液中で鎖状構造と環状構造の両方の形で存在します。 この環状のD-グルコピラノースを立体的な構造式で表わすと 下のようになります。 環状になった部分の細い線は画面の奥に位置し、太い線は画面の手前側に位置します |
|
さらにD-グルコピラノースを分子モデル で見てみましょう。 |
 |
| グルコピラノース |
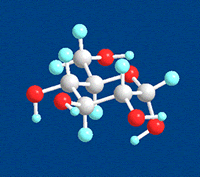 |
D-グルコースの炭素原子5個と酸素原子1個が環状になったものをD-グルコピラノースといいます。 左の分子モデルはD-グルコピラノースを表わしています。灰色の玉は炭素(C)原子、赤い玉は酸素(O)原子、水色の玉は水素(H)原子を表わしています。玉と玉をつないでいる棒は原子と原子の間の結合を表わしています。 |
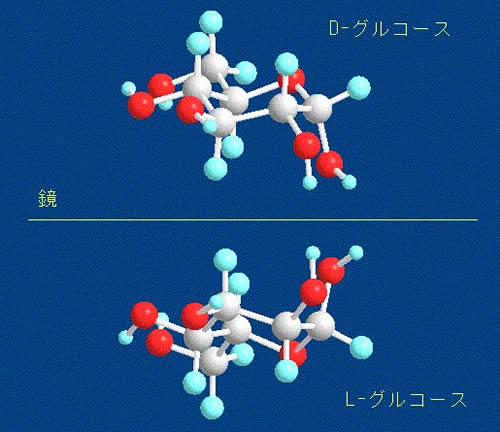
| D-グルコピラノース/D-グルコピラノースとL-グルコピラノース |
| D-グルコースには鎖状構造のものと環状構造のものの2種類が存在します。環状構造で炭素原子5個と酸素原子1個からなる環状構造のものをD-グルコピラノースといいます。グルコースには人間の左手と右手のようにちょうど鏡で写したような関係にあって、互いに重ならない構造のものがあり、1つをD-グルコース、他をL-グルコースといいます。 |
| D-グルコピラノース |
| D-グルコースには鎖状構造のものと環状構造のものの2種類が存在します。環状構造で炭素原子5個と酸素原子1個からなる環状構造のものをD-グルコピラノースといいます。グルコースには人間の左手と右手のようにちょうど鏡で写したような関係にあって、互いに重ならない構造のものがあり、1つをD-グルコース、他をL-グルコースといいます。 したがって、グルコピラノースにはD-グルコピラノースとL-グルコピラノースが存在します。天然にあるグルコピラノースはD-体のものです。デンプンはこのD-グルコピラノースがいくつもつながったものです。 D-グルコースとL-グルコースの分子モデルを下の2つの図に示します。下の図で、灰色の玉は炭素原子、赤い玉は酸素原子、水色の玉は水素原子を表わしています。玉と玉をつないでいる棒は原子と原子の間の結合を表わしています。上のものがD-グルコースで下がL-グルコースです。これらは互いに鏡面に写った像の関係にあります。 天然に存在するものはD-体のものです。D-体とL-体は偏光に対して違った振る舞いをするので、光学異性体といわれます。 |
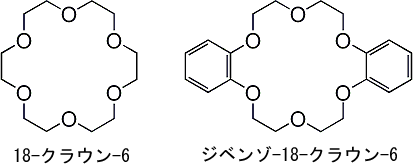
| クラウンエーテル |
| クラウンエーテルは酸素、窒素などの電子供与性原子をもつ大環状化合物で、その空孔径に合ったイオン半径をもつカチオンと錯体を作ります。そのため、有機溶媒に溶けない無機塩を溶解することができます。下にクラウンエーテルの例を示します。 |
 |
| カリックスアレン |
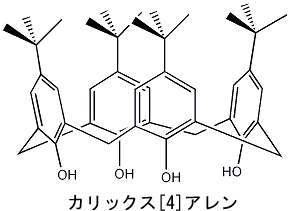 |
カリックスアレンはフェノール誘導体がメタ位で環状につながった化合物です。この名前はギリシャ語の杯(カリックス)に由来しており、その名前のように杯の形をしています。カリックスアレンはフェノールのヒドロキシル基側で金属イオンを包接し、ベンゼン環側で有機化合物を包接する性質があります。 左にカリックスアレンの例を示します。 |
| ノーベル化学賞 |
| スウェーデンの化学者・技術者であるアルフレッド・ノーベルはダイナマイトを発明し大金持ちになりました。ノーベル賞はノーベルが
1901年に世界の平和を祈願して設けた世界最高の賞です。前年度に人類の幸福に具体的な貢献をした人に送るという賞で、物理学賞、化学賞、医学生理学賞、文学賞、平和賞、経済学賞の6つがあります。 1901年の第1回のノーベル物理学賞はX線で有名なウィルヘルム・コンラッド・レントゲンが受賞しています。 日本人で最初のノーベル賞受賞者は1949年に物理学賞を受賞した湯川秀樹博士です。1965年には朝永振一郎博士、1973年には江崎玲於奈博士が物理学賞を受賞しています。 化学賞では福井謙一博士が1981年に、また白川英樹博士、野依良治博士、田中耕一氏が2000, 2001, 2002年と3年連続で化学賞を受賞しました。 2002年には化学賞の田中耕一氏とともに小柴昌俊博士が物理学賞を受賞しています。 医学生理学賞は1987年に利根川進博士が受賞しています。 |
| デンプン |
| デンプンはD-グルコースがたくさんつながってできたもので、糖の仲間です。炭水化物ということもあります。 |
| 糖 |
| 糖はもともと一般式 Cn(H2O)m で表わされる1群の化合物をさしていましたが、現在ではこの一般式に当てはまらないデオキシリボース(DNAの構成成分)や窒素やイオウを含むものも糖に分類しています。 |
| ヒドロキシル基/水酸基 |
| ヒドロキシル基(水酸基)はアルコールやフェノールの特性基で -OH で表わされます。ヒドロキシル基のことを水酸基ともいいます。お酒に入っているアルコールはエタノール(C2H5OH)です。 |
| 1級水酸基 |
| ヒドロキシル基が結合している炭素原子に1個の炭素原子が結合しているものを1級水酸基(ヒドロキシル基)といいます。エタノールの-OHがその1つの例です。 |
| 2級水酸基 |
| ヒドロキシル基が結合している炭素原子に2個の炭素原子が結合しているものを2級水酸基(ヒドロキシル基)といいます。2-プロパノール(CH3-CH(OH)-CH3)の-OHがその1つの例です。 |
| エーテル結合 |
| エーテルは一般式 R-O-R' で表される中性の化合物をいいます。ここで、RとR' は炭化水素残基です。エーテルに含まれる C-O-C 結合をエーテル結合といいます。 |
| 疎水的(疎水性) |
| 水との相互作用が弱く、水との親和性が弱い性質をいいます。炭素と水素だけからできている炭化水素は代表的な疎水性の化合物です。水溶液中で疎水性の物質同士は互いに集まるために1種の結合力が働くとみなすことができ、その力を疎水結合ということがあります。 |
| 可視(光線) |
| 光は波長の短い領域から「紫外線」、「可視光線」、「赤外線」などに分類されます。紫外線と赤外線は人間の目では見ることができません。紫色から赤色までの色をもった光は目で見ることができるので、可視光(線)と呼ばれます。その波長はおおよそ 400 - 700 nm の領域にあります。紫外線は波長が短いので、エネルギーが大きく日焼けなどの化学反応を起こす作用があります。赤外線は熱線とも呼ばれるように物質に吸収されると熱エネルギーに変わりやすいのです。 |
| 分子間力 |
| 分子間力は分子と分子の間に働く力のことをいいます。異なった種類の原子どおしの結合では共有結合に関与している電子はどちらかの原子に偏って分布することがあります。そのため、分子全体として電子の分布の偏りができて、分子が極性をもつことがあります。このような分子どおしでは分子間に静電気的な引力が働きます。極性をもった分子と極性のない分子(無極性分子)では2つの分子が近づくと無極性分子に電子の偏りが誘起されて、極性分子どおしと同様に分子間に引力が働きます。無極性分子どおしでは1つの分子に瞬間的に電子の偏りができると、もう1つの無極性分子に電子の分布の偏りが誘起されて、分子間に引力が働くようになります。このような分子間力は共有結合などと比べると非常に弱い力です。 |
| 超分子 |
| 分子が複数集まって1つの分子のように振舞う集合体を超分子といいます。 |
| 非共有電子対 |
| 他の原子との結合に関与せずに2個の対となっている外殻電子のことをいいます。 |
| 外殻電子 |
| 原子中の電子は空間的におおよそ殻状に分布しています。これらの電子のうちで原子核から遠いところに分布する外殻軌道の電子を外殻電子といいます。外殻軌道の電子は化学結合に最も重要な役割を果たします。炭素、窒素、酸素などの第2周期の元素では2s軌道と2p軌道の電子が外殻電子です。 |
| コレステロール |
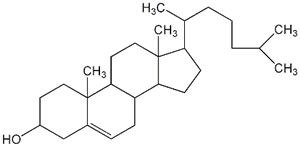 |
コレステロールは動物の体に脂肪酸のエステルなどとして存在します。コレステロールの構造式を左に示します。 |
| ナフタレン |
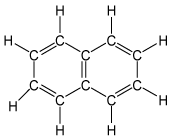 |
ナフタレンの分子式はC10H8です。常温で結晶ですが、特有の臭いがあります。 防虫剤として使われています。左にナフタレンの構造式を示します。 |
| ベンゼン |
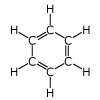 |
ベンゼンの分子式はC6H6です。 芳香族化合物の基本となる化合物で、常温で液体です。 左にベンゼンの構造式を示します。 |